| PH de maceración |
| Cuando maceramos, deseamos que el pH este entre un rango de (5,4 a 5,6). Casi todos los cerveceros conseguimos macerar entre dichos rangos de PH, pero para conseguirlo solemos utilizar o bien malta acida o acido láctico o acido fosfórico. Mi experiencia: cuando empecé a hacer cerveza para medir el PH utilizaba tiras calibradas de papel, más tarde me compre un medidor de PH. Un día que estaba haciendo cerveza calibre mi medidor de PH y para bajar el PH del agua de macerado eche ácido láctico como siempre, pero el PH prácticamente no bajaba así que seguí echando ácido láctico y así sucesivamente hasta conseguir bajar el PH hasta 5,5. El lote de cerveza tuve que tirarlo por el fregadero, imbebible, ese día decidí 3 cosas: -Nunca más utilizar ni malta ácida, ni ácido láctico, ni fosfórico, dan mal sabor a la cerveza. -Comprarme un medidor de PH decente y fiable. -Comprarme un equipo de agua de osmosis para saber realmente con que agua estoy elaborando la cerveza, en este artículo explico el porqué. |
| Objetivo del artículo |
| Como todo cervecero ya que el agua es tan importante en el proceso de elaboración empecé a leer artículos y al principio no entendía nada, que si dureza, alcalinidad, PH. No soy químico y me costó entenderlo, el objeto del artículo es explicarlo de una forma sencilla para que el cervecero no se encuentre con los mismos problemas de comprensión que yo me encontré. |
| PH del agua pura |
| Empecemos explicando que es el PH. En el agua el hidrógeno (H) y el oxígeno (O) se encuentra en la forma química H2O (unidos), parte como hidrógeno (H+ ) y parte como hidroxilos (OH– ). Si el agua es totalmente pura su pH es 7 (la misma cantidad de iones de H+ que de OH– ) y la podríamos representar con este gráfico. Nº de iones (H+ ) :3 Nº de iones (OH– ):3 |
 |
| PH del agua si le añadimos un acido |
| Si añado ácido sulfúrico al agua (SO4 H2), este se separa de esta forma: dando lugar a la aparición de más iones H+ En el agua ahora tenemos Nº de iones (H+ ) : 5 Nº de iones (OH– ): 3 Nº de iones (SO4=): 1 Ahora en nuestra agua sigue habiendo 3 iones (OH–), pero hay 5 iones (H+). Nuestro PH será menor que 7, porque la concentración de iones (H+ ) es mayor que la de (OH– ) Si añadimos un ácido al agua el PH bajará. |
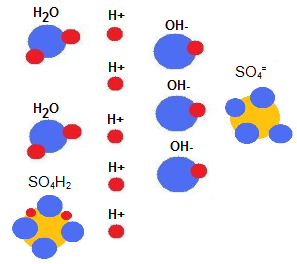 |
| Macerado con agua de Osmosis |
| Mediante la Osmosis eliminamos del agua todos los minerales para dejarla pura. PH=7 El agua para hacer cerveza debe contener iones de calcio (Ca++) o de magnesio (Mg++), por ello al agua de osmosis le añadimos sales en las dosis adecuadas. |
| Partimos de un agua de osmosis y supongamos que añadimos iones de calcio (Ca++). Agua inicial de macerado. Nº de iones (H+ ) :3 Nº de iones (OH– ): 3 Nº de iones (Ca++) :3 |
 |
| Descenso del PH del agua debido al fosfato de la malta durante la maceración. Kolbach, un científico de elaboración de cerveza alemán, encontró que 2 iones fosfato de la malta (HPO4 – – ) reaccionan con 3 iones de calcio (Ca++) o de magnesio del agua. Esta reacción libera 2(H +), así como fosfato de calcio (Ca3(PO4)2) que es prácticamente insoluble en el mosto y precipita. El aspecto importante, es la liberación de 2(H+) y el descenso del PH del mosto. Para que se produzca este proceso y el PH del mosto descienda, es necesario que nuestra agua disponga de iones de calcio y magnesio suficientes. El agua obtenida en el macerado, partiendo de un agua de osmosis: Nº de iones (H+ ) :5 Nº de iones (OH– ):3 Nº de Ca3 (PO4)2 :1 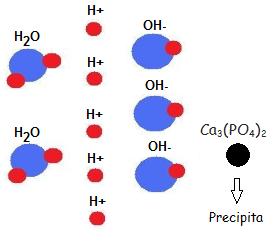 |
| Macerado con agua del grifo o embotellada (El agua no es de osmosis) |
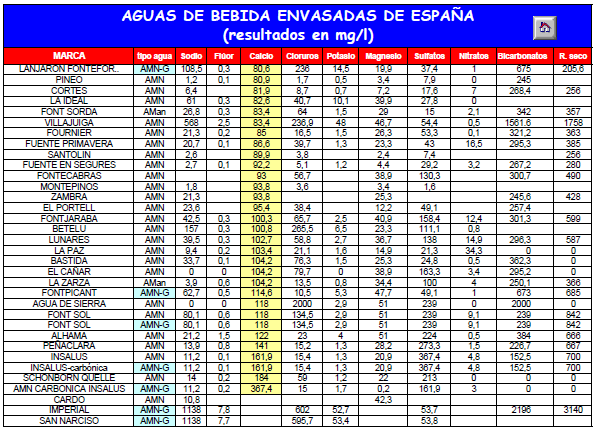
| Cuando el agua de lluvia cae de la atmósfera, recoge CO2 para formar ácido carbónico. Este ácido carbónico puede entonces reaccionar con minerales como la roca caliza para formar: El agua del grifo contendrá iones de calcio (Ca++) y iones de bicarbonato (HCO3–) Los iones bicarbonato (HCO3–) se unirán a los iones (H+) para formar acido carbónico (H2CO3) Los iones de bicarbonato reaccionan con los iones (H+) disminuyendo estos y aumentando el PH del agua. La alcalinidad es uno de los datos más importantes en la elaboración de la cerveza. Si aplicamos osmosis al agua su alcalinidad será cero, ya que eliminamos los iones bicarbonato (HCO3–) Nota: En el anexo se indica la alcalinidad de las principales marcas de agua embotellada. |
| Partimos de un agua de grifo que contiene alcalinidad (iones bicarbonato) y maceramos: Iones bicarbonato (HCO3–):2 Nº de H2O :2 Nº de iones (H+ ) :3 Nº de iones (OH– ) :3 Nº de iones (Ca++ ) :3 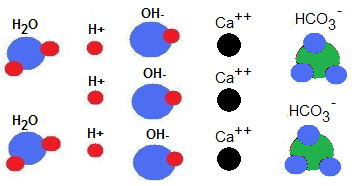 |
| Reacciones químicas durante el macerado. Como comentamos 2 iones fosfato de la malta (HPO 4 – –) reaccionan con 3 iones de calcio (Ca++) para formar: Esta reacción libera 2(H +), así como fosfato de calcio (Ca3(PO4)2) que se precipita. Sin embargo, el aspecto importante es que los iones (H+) obtenidos que contribuían a bajar el PH, reaccionaran con los iones de bicarbonato (HCO 3 – ) para formar agua (H2O) y CO2 Los iones de bicarbonato actúan como tapones ante la bajada del PH. El PH no ha disminuido. El agua durante el macerado: Alcalinidad residual, iones (HCO3–):0 Nº de H2O :4 Nº de iones (H+ ) :3 Nº de iones (OH– ) :3 Nº de CO2 : 2 Nº de Ca3 (PO4)2 : 1  |
| Análisis del resultado: Partimos de un agua alcalina con una alcalinidad inicial de 2 iones (HCO3–), durante el macerado los iones de fosfato de la malta, reaccionan con los iones de calcio para liberar 2 iones de (H+) que iban a contribuir a la bajada del PH, pero como en el agua había iones (HCO3–) se han combinado con estos y el PH en el macerado no ha disminuido. |
| Nomenclatura a utilizar en este artículo |
| -Alcalinidad inicial: es la alcalinidad del agua a utilizar para elaborar la cerveza. En el ejemplo está constituida por 2 iones de bicarbonato (HCO3–). -Alcalinidad eliminada por los fosfatos: es la alcalinidad que se elimina al combinarse los iones de calcio, con los iones de fosfato de la malta y los iones de bicarbonato. Este nombre es inventado, el nombre correcto es “dureza efectiva”, pero para una mejor comprensión me vais a permitir utilizarlo. En el ejemplo se han eliminado 2 iones de bicarbonato (HCO3–). -Alcalinidad residual: es la alcalinidad que tendrá el mosto al restarle a la alcalinidad inicial, la alcalinidad eliminada por los fosfatos. En el ejemplo la alcalinidad residual: 0. |
| Importancia de la alcalinidad |
| Con lo explicado hasta ahora podemos intuir varias cosas que más adelante las explicaremos con más detenimiento. -Si utilizamos agua de osmosis en el macerado, su alcalinidad inicial es cero. Al combinarse los iones de calcio, con los iones de fosfato de la malta se liberan iones (H+) que hacen que baje el PH en el macerado. Si hacemos una cerveza clara fácilmente obtendremos valores de PH comprendidos entre 5,4 y 5,6. -Si utilizamos agua de grifo con mucha alcalinidad inicial, la alcalinidad eliminada por los fosfatos normalmente no podrá compensarla y resultara que en el macerado tendremos una alcalinidad residual (AR) y además el PH no habrá disminuido. Para poder bajar el PH necesitare aportar por ejemplo acido láctico que compense la alcalinidad residual y poder bajar el PH. Como ya comente el acido láctico aporta malos sabores a la cerveza. |
| Alcalinidad residual |
| El trabajo de Kolbach encontró que en el macerado no todos los iones de calcio y magnesio del agua reacción con los fosfatos de la malta. Descubrió que sólo 2 de cada 7 iones de calcio y uno de cada 7 iones de magnesio reaccionan con los fosfatos de la malta para liberar iones (H+). Esto hizo posible calcular matemáticamente la alcalinidad residual (AR) utilizando la formula siguiente: AR= alcalinidad inicial – alcalinidad eliminada por los fosfatos No te asustes no hace falta que resuelvas esta fórmula matemáticamente, John Palmer la resuelve por nosotros gráficamente y además la relaciona con el PH que vamos a conseguir en el macerado según el estilo de cerveza que vamos a elaborar. Un poco de unidades: -Normalmente en los informes de aguas las concentraciones de los minerales y su alcalinidad vienen expresadas en mg/l o en ppm (partes por millón). Estas unidades son iguales ya que 1 litro de agua pesa un millón de miligramos. –John Palmer en su libro “How to Brew”, resuelve la fórmula gráficamente facilitándonos al cervecero su resolución. El resultado de la AR lo expresa en (ppm de CaCO3). En los informes de aguas suele ser frecuente expresar la alcalinidad en (ppm de HCO3–) o como su cantidad equivalente en (ppm de CaCO3). La relación entre ellas es: Alcalinidad como (ppm de HCO3–)= alcalinidad como (ppm de CaCO3) x 1,22 |
| Ejemplo de cálculo de la alcalinidad residual (AR) matemáticamente y gráficamente. |
| Tómanos del anexo del artículo los datos del agua embotellada de la marca FONTVELLA. Ca= 33,5 mg/l Mg= 6,6 mg/l bicarbonato (HCO3– )= 135 mg/l Alcalinidad inicial= 135 (ppm de HCO3–) o 135/1,22= 110,65 (como ppm de CaCO3). Alcalinidad eliminada por los fosfatos= 33,5/1,4 + 6,6/1,7 = 27 ,81 (ppm de CaCO3). Alcalinidad residual= 110,65 – 27,81 = 82,83 (ppm de CaCO3). |
 En el cálculo grafico ideado por John Palmer además de indicarnos la alcalinidad residual nos muestra el PH que conseguimos en el macerado debido a los fosfatos. PH aproximado: 5,84 |
| Contenido ácido de las maltas. |
| Hasta ahora no hemos considerado que las maltas disponen de componentes ácidos, contra más tostada sea la malta mayor número de componentes ácidos tiene. Como hemos visto anteriormente los ácidos hacen que disminuya el PH en el macerado. El problema que tenemos es calcular matemáticamente el descenso del PH debido a esos ácidos. John Palmer considero en su gráfica dicho descenso del PH y añadió una nueva figura en su gráfica, el color de la cerveza a elaborar. Mucho color supone que utilizo maltas caramelo o tostadas que tienen más componentes ácidos que las maltas base. Si con los fosfatos consigo un PH=5,84 y elaboro un cerveza tostada, al considerar los compuestos ácidos de las maltas caramelo o tostadas, alcanzare un PH comprendido entre 5,4 y 5,6. El agua envasada FONTVELLA es adecuada para elaborar cervezas tostadas. 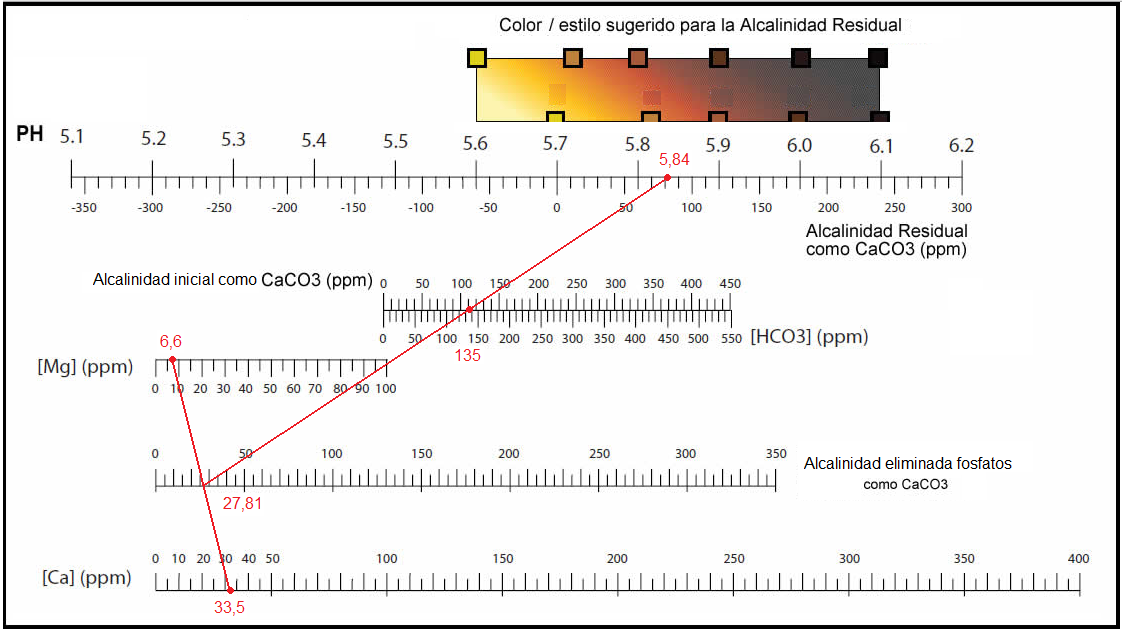 |
| Que puedo hacer si deseo elaborar con agua FONTVELLA una cerveza algo más clara. Podemos subir el contenido de calcio hasta alcanzar el color deseado. En este caso debemos subir el calcio hasta: Ca=120 mg/l 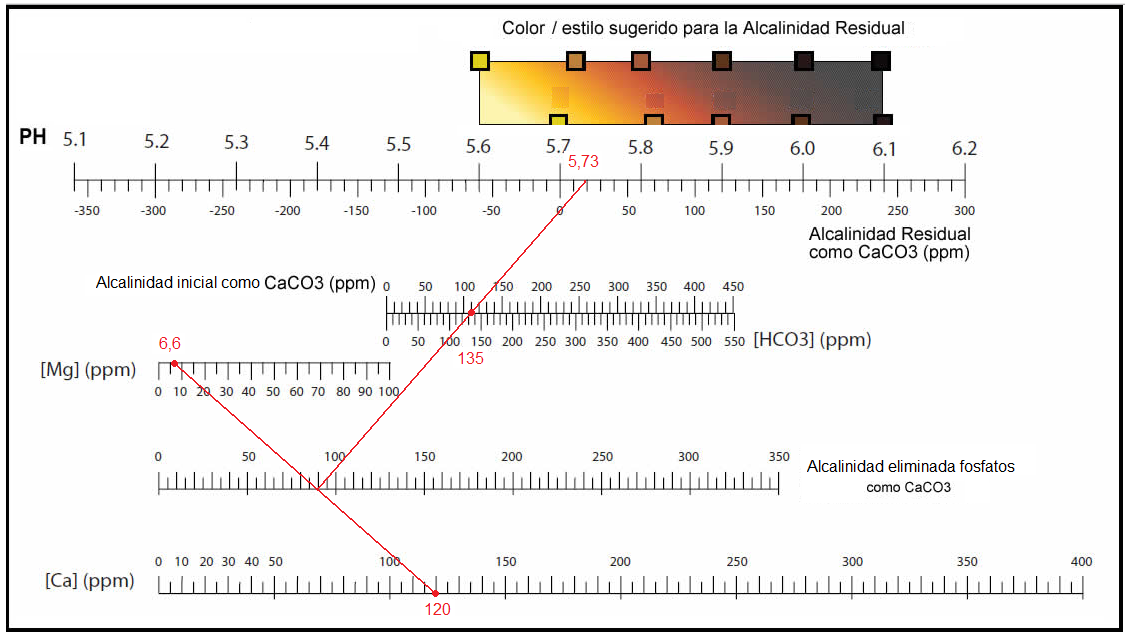 |
| Estilo adecuado de cerveza para un agua de osmosis. |
| Yo normalmente realizo IPAS muy claras y al agua de osmosis le añado: Ca= 100 ppm Mg= 5 ppm Alcalinidad inicial= 0 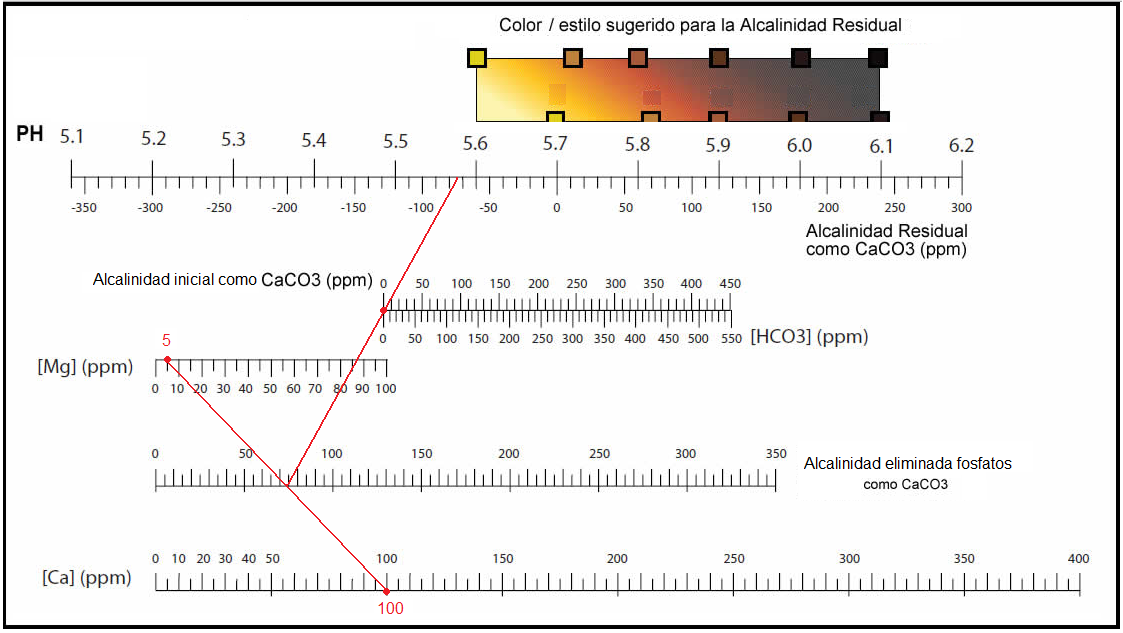 |
| Dublin (cerveza Guinness) |
| En Dublin triunfaron las cervezas Stout, su agua es muy adecuada para ese estilo. Ca= 118 ppm Mg= 4 ppm. Alcalinidad inicial=319 (ppm de HCO3–)  |
| Burton upon Trent en Inglaterra. |
| En la región de Burton triunfo el estilo IPA, como es posible que con una alcalinidad inicial tan alta de 320 (ppm de HCO3–) se pueda hacer una cerveza más bien clara como es una IPA. Esto es debido a que la cantidad de calcio que contiene es brutal. Ca= 352 ppm y Mg= 24 ppm. El estilo ideal de cerveza con el agua de Burton son las cervezas más bien claras.  |
| Resumen: Una vez conocida nuestra agua, podemos conocer el estilo de cerveza que más se ajusta a ella. |
| ANEXO |
 |
 |
![]()
